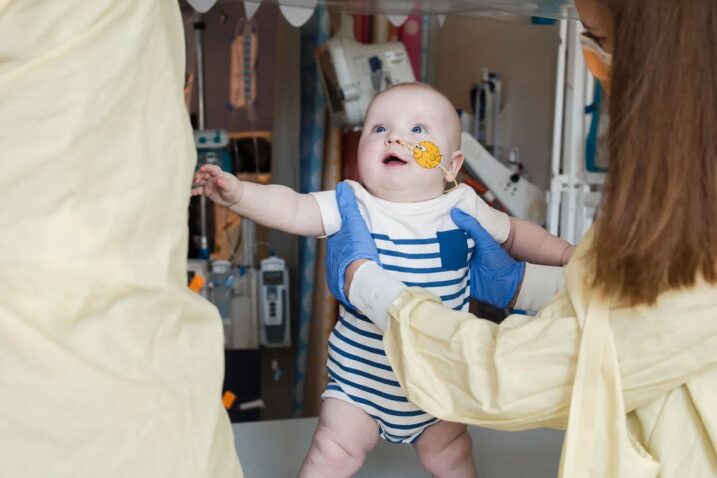
Foto Children's Hospital of Philadelphia
Postupak korišten na 9 i pol mjeseci starom dječaku s rijetkim stanjem ima potencijal pomoći ljudima s tisućama drugih neuobičajenih genetskih bolesti
povezane vijesti
Nešto nije bilo u redu s bebom Kylea i Nicole Muldoon. Liječnici su nagađali. Možda je to bio meningitis? Možda sepsa? Dobili su odgovor kada je KJ imao samo tjedan dana.
Imao je rijedak genetski poremećaj, nedostatak CPS1, koji pogađa samo jedno od 1,3 milijuna beba. Ako preživi, imat će teška mentalna i razvojna kašnjenja i na kraju bi mu trebala transplantacija jetre. Ali polovica svih beba s tim poremećajem umire u prvom tjednu života.
Liječnici u Dječjoj bolnici u Philadelphiji ponudili su Muldoonima utješnu skrb za njihovu bebu, priliku da se odreknu agresivnih tretmana suočeni s tmurnom prognozom.
„Voljeli smo ga i nismo htjeli da pati“, rekla je gđa. Muldoon za New York Times. Ali ona i njezin suprug odlučili su dati KJ-u priliku.
Ušao u medicinsku povijest
Umjesto toga, KJ je ušao u medicinsku povijest. Beba, koja sada ima 9 i pol mjeseci, postala je prvi pacijent bilo koje dobi koji je podvrgnut prilagođenom tretmanu uređivanja gena, prema riječima njegovih liječnika. Primio je infuziju napravljenu samo za njega i dizajniranu da ispravi njegovu preciznu mutaciju.
Istraživači koji su vodili napore za spašavanje KJ-a predstavljaju svoj rad u četvrtak na godišnjem sastanku Američkog društva za staničnu i gensku terapiju, a objavljuju ga i u New England Journal of Medicine.
Implikacije tretmana idu daleko izvan liječenja KJ-a, rekao je dr. Peter Marks, koji je bio dužnosnik Uprave za hranu i lijekove (FDA) zadužen za regulaciju genske terapije sve dok nedavno nije dao ostavku zbog neslaganja s Robertom F. Kennedyjem Jr., ministrom zdravstva i socijalnih usluga.
Više od 30 milijuna ljudi u Sjedinjenim Državama ima jednu od više od 7000 rijetkih genetskih bolesti. Većina ih je toliko rijetka da nijedna tvrtka nije spremna potrošiti godine razvijajući gensku terapiju koju bi tako malo ljudi trebalo.
Ali KJ-ev tretman – koji je izgrađen na desetljećima istraživanja financiranih od strane savezne američke vlade – nudi novi put tvrtkama za razvoj personaliziranih tretmana bez prolaska kroz godine skupog razvoja i testiranja.
Bolesti poput KJ-ove su rezultat jedne mutacije – netočnog slova DNK među tri milijarde u ljudskom genomu. Ispravljanje zahtijeva precizno ciljanje pristupom koji se naziva uređivanje baza.
Molekularni GPS
Da bi se to postiglo, tretman je omotan molekulama masnih lipida kako bi se zaštitio od razgradnje u krvi na putu do jetre, gdje će se izvršiti uređivanje. Unutar lipida nalaze se upute koje naređuju stanicama da proizvode enzim koji uređuje gen. Također nose molekularni GPS – CRISPR – koji je izmijenjen da “puže” duž DNK osobe dok ne pronađe točno slovo DNK koje treba promijeniti.
Iako je KJ-ev tretman bio prilagođen tako da je CRISPR pronašao samo njegovu mutaciju, ista vrsta metode mogla bi se prilagoditi i koristiti iznova za ispravljanje mutacija na drugim mjestima na DNK neke osobe. Trebalo bi promijeniti samo CRISPR upute koje vode do mjesta na DNK s mutacijom. Tretmani bi bili jeftiniji, „barem za red veličine“, rekao je dr. Marks.
Ova je metoda za dr. Marksa, koji je napisao uvodnik uz istraživački rad, jedna od najpotencijalnije transformativnih tehnologija.
Na kraju bi se mogla koristiti i za češće genetske poremećaje poput anemije srpastih stanica, cistične fibroze, Huntingtonove bolesti i mišićne distrofije.
I, ističe dr. Marks, „mogla bi zaista transformirati zdravstvenu skrb.“
Može li spasiti bebu?
Priča o KJ-evoj personaliziranoj terapiji genskim uređivanjem započela je u večernjim satima 8. kolovoza, kada je dr. Kiran Musunuru, istraživač genskog uređivanja na Sveučilištu Pennsylvania, primio e-mail od dr. Rebecce Ahrens-Nicklas iz Dječje bolnice u Philadelphiji. Rođena je beba, a genetsko testiranje pokazalo je da ima nedostatak CPS1.Može li spasiti bebu?
Dr. Musunuru je počeo istraživati upotrebu genskog uređivanja za prilično uobičajene genske mutacije. Razvoj genskog uređivača za liječenje pacijenata je proces koji može trajati godinama. Ali KJ nije imao godine čekanja – možda samo šest mjeseci prije rastućeg rizika od teškog oštećenja mozga ili smrti.
„U ovom trenutku, sat počinje odbrojavati“, rekao je dr. Musunuru. „Ovo je stvarni život. Ovo nije hipotetski.“
KJ-evu bolest uzrokuje nemogućnost da se tijelo riješi amonijaka, nusprodukt metabolizma proteina. Amonijak se nakuplja u krvi i prelazi u mozak. Liječnici su bebu stavili na dijetu koja je ozbiljno ograničavala proteine - tek toliko da raste.
Također je uzimao lijek, glicerol fenilbutirat, koji je pomogao ukloniti amonijak iz krvi. Ali i dalje je bio u visokom riziku od ozljede mozga ili smrti. Bilo koja bolest ili infekcija mogla bi povisiti razinu amonijaka i uzrokovati nepovratnu štetu mozgu.
KJ je živio u bolnici pod 24-satnom njegom. Izgradnja sustava za uređivanje gena za bebu Muldoonovih i njegovo testiranje nije bilo lako.
Dr. Musunuru očeo je raditi s Fjodorom Urnovim na Sveučilištu Kalifornija u Berkeleyu, koji je osigurao da nema neočekivanih i štetnih genskih uređivanja drugdje u DNK.
Zapanjujuća brzina
Dr. Urnov je dio akademske suradnje s Danaher Corporation, tvrtkom sposobnom proizvesti genski editor za KJ-a po standardu koji bi omogućio njegovu upotrebu kod pacijenta.
Danaher je pak surađivao s dvije druge tvrtke u svom vlasništvu, dvije dodatne biotehnološke tvrtke i još jednim istraživačkim institutom, rekao je Sadik Kassim, glavni tehnološki direktor za genomske lijekove.
„U svakom koraku procesa uvijek smo očekivali da će netko reći: ‘Ne, oprostite’“, rekao je dr. Kassim. „I to bi bio kraj priče.“ Ali njegovi su strahovi bili neutemeljeni. Danaher i druge tvrtke naplaćivale su samo sirovine za izradu lijeka, dodao je.
FDA je također olakšala regulatorno odobrenje liječenja, rekla je dr. Ahrens-Nicklas. Deseci istraživača mjesecima su sve ostalo ostavljali po strani.
Dr. Urnovističe da su znanstvenici uložili mnogo truda u ovo istraživanje. Ističe da “takva brzina proizvodnje CRISPR-a kliničke razine za genetsku bolest nema presedana u našem području. Ni blizu.”
David Liu s Harvarda, čiji je laboratorij izumio metodu uređivanja gena koja se koristi za ispravljanje KJ-eve mutacije, rekao je da je brzina „zapanjujuća“.
„Ovi koraci tradicionalno traju veći dio desetljeća, ako ne i dulje“, rekao je.
Jedan od najstrašnijih trenutaka
Tek kada je rješenje za uređivanje gena bilo dostupno i FDA je odobrila rad istraživača, dr. Ahrens-Nicklas pristupila je KJ-evim roditeljima.
„Jedan od najstrašnijih trenutaka bio je kada sam ušla u sobu i rekla: ‘Ne znam hoće li uspjeti, ali obećavam da ću učiniti sve što mogu da bude sigurno’“, rekla je.
Ujutro 25. veljače KJ je primio prvu infuziju, vrlo nisku dozu jer nitko nije znao kako će beba reagirati. Bio je u svojoj sobi, u krevetiću u kojem je proveo cijeli život. Imao je 6 mjeseci i bio je u sedmom percentilu za svoju težinu.
Dr. Musunuru pratio je dvosatnu infuziju, osjećajući se, kako je rekao, „i uzbuđeno i prestrašeno“. KJ je prespavao.
U roku od dva tjedna, KJ je mogao jesti jednako proteina kao zdrava beba. Ali i dalje mu je bio potreban lijek za uklanjanje amonijaka iz krvi – znak da uređivač gena još nije ispravio DNK u svakoj zahvaćenoj stanici.
Liječnici su mu dali drugu dozu 22 dana kasnije.
Uspjeli su prepoloviti dozu lijeka. U tom je vremenu obolio od nekoliko virusnih bolesti, koje bi inače izazvale zastrašujuće poraste razine amonijaka. Ali, rekla je dr. Ahrens-Nicklas, „prebolio ih je.“
Prije tjedan i pol, tim je dao KJ-u treću dozu.
“Najznačajnija stvar koju smo ikad učinili”
Prerano je znati može li potpuno prestati uzimati lijek, ali doza je znatno smanjena. I dovoljno je dobro da tim počne planirati njegov otpust iz bolnice. Dostiže razvojne prekretnice i njegova težina je sada u 40. percentilu za njegovu dob, ali još nije poznato hoće li biti pošteđen transplantacije jetre.
Rezultat „je trijumf ulaganja američkog naroda u biomedicinska istraživanja“, rekao je dr. Urnov.
Istraživači su naglasili ulogu koju je vladino financiranje odigralo u razvoju. Rad je, rekli su, započeo prije nekoliko desetljeća saveznim financiranjem osnovnih istraživanja bakterijskih imunoloških sustava.
To je na kraju, uz veću saveznu podršku, dovelo do otkrića CRISPR-a. Savezna ulaganja u sekvenciranje ljudskog genoma omogućila su identifikaciju KJ-eve mutacije.
Američko financiranje podržalo je laboratorij dr. Liua i njegovo otkriće uređivanja. Savezni program za proučavanje uređivanja gena podržao je istraživanje dr. Musunurua. Paralelno s tim odvijao se savezno financiran rad koji je doveo do razumijevanja KJ-eve bolesti.
„Ne mislim da se ovo moglo dogoditi u bilo kojoj drugoj zemlji osim u SAD-u“, rekao je dr. Urnov.
Oni koji su radili na spašavanju KJ-a bili su ponosni, rekao je dr. Urnov.
„Svi smo jedni drugima rekli: ‘Ovo je najznačajnija stvar koju smo ikada učinili.’“



















